5M丁酸钠溶液(细胞转染)
储存条件:-20℃保存,有效期一年。
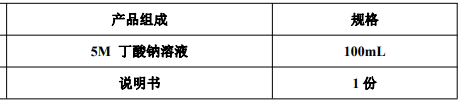
产品组成:
产品介绍:
Sodium Butyrate,中文名为丁酸钠,是一种 HDAC(Histone deacetylase, 组蛋白去乙酰化酶)抑制剂。
Sodium Butyrate 是一种短链脂肪酸盐,可以不依赖于 p53 途径诱导结肠癌细胞凋亡,同时可以诱导多种细胞的细胞凋亡;可以抑制 c-myc 基因的剪接,从而干扰其信号转导途径及钙离子从细胞内钙库的释放。
Sodium Butyrate 分子量为 110.09,分子式为 C4H7O2Na,CAS Number:156-54-7。
本产品经过过滤除菌处理,可以用无菌水稀释后使用。
使用举例:
外源基因在真核细胞表达技术
一、生化方法
1、磷酸钙介导的质粒 DNA 转染真核细胞
(1)转染前 24 h,通过胰酶消化收集细胞,用适当的完全培养基以 1×105 至 4×105 细胞/cm2 的密度平铺细胞于 60 mm 组织培养皿或 12 孔板上。于含 5%~7% CO2 的 37℃温箱孵育 20~24 h。转染前 1 h 换液。
(2)按照下属方法制备磷酸钙-DNA 沉淀:于 5 ml 灭菌塑料管内混合 100μl 2.5 mol/L CaCl2 与 25μg 质粒DNA,如有必要用 0.1×TE(pH7.6)将体积补至 1 ml。室温下将以上 2×钙-DNA 溶液与等体积的 2×HEPES盐溶液混合。迅速弹敲试管侧壁混匀溶液,静置 1 min。
(3)立即将磷酸钙-DNA 悬液转移至上述单层细胞的细胞培养基中。每 1 ml 培养基加 0.1 ml 悬液。轻轻摇动平皿混匀培养基,培养基会变成混浊的橘黄色。一旦形成 DNA 沉淀,转染效率会大大降低,因此此步动作应尽可能迅速。如果是用氯喹、甘油与/或丁酸钠处理细胞,直接进行步骤 5。
(4)如果转染的细胞不用转染促进剂处理,则置于含 5%~7%CO2 的 37℃温箱孵育。2~6 h 后,吸去培养基与 DNA 沉淀。加入 5 ml 37℃预热的完全培养基,将细胞放回孵箱孵育 1~6 天。继续步骤 6 检测转染DNA 的瞬时表达,或者如果是稳定转化则直接进行步骤 7。
(5)在磷酸钙-DNA 沉淀物的存在下用氯喹处理细胞或者吸去沉淀溶液后将细胞暴露于甘油与丁酸钠中会促进细胞吸收 DNA。
2、用氯喹处理细胞
氯喹是一种弱碱,推测是通过抑制细胞内溶酶体水解酶降解 DNA 而发挥作用(Luthman and Magnusson1983)。细胞对氯喹毒性的敏感度限制了培养基中加入氯喹的浓度及时间,不同细胞所需氯喹最佳浓度根据经验而定。
(1)在把磷酸钙-DNA 沉淀物加入细胞前或后按 1:1000 将 100 mmol/L 氯喹直接加入培养基中。
(2)细胞于含 5%~7%CO2 的 37℃温箱中孵育 3~5 h。
(3)在用 DNA 于氯喹孵育细胞后,移去培养基,用磷酸盐缓冲液洗涤细胞,加 5 ml 预热的完全培养基。
细胞于孵箱中培养 1~6 天。继续步骤 6 检测转染 DNA 的瞬时表达,或者直接进行步骤 7 以获得稳定转化子。
3、丁酸钠处理细胞
丁酸钠的作用机制并不确定;但它是组蛋白乙酰化形成使外来质粒 DNA 趋于转录的染色质结构(Workman and Kingston 1998)。
(1)甘油休克处理后,将 500 mmol/L 丁酸钠直接加入生长培养基(甘油处理的步骤 d)。细胞类型不同,所用丁酸钠的浓度也不同。例如:
CV-1 10 mmol/L
NIH-3T3 7 mmol/L
HeLa 5 mmol/L
CHO 2 mmol/L
其他细胞系所需浓度依经验而定。
(2)细胞于孵箱中培养 1~6 天。继续步骤 6 检测转染 DNA 的瞬时表达,或者直接进行步骤 7 以获得稳定转化子。
(3)若要检测细胞转染后导入 DNA 的瞬时表达,可在转染后 1~6 天收获细胞。杂交分析 DNA 或 RNA。
通过体内代谢标记进行放射免疫、免疫印渍、免疫沉淀或测定细胞提取物的酶活性来分析新合成蛋白。
(4)分离稳定转染体
用非选择性培养基孵育细胞 24~48 h,使转染的 DNA 有足够时间表达。
胰酶消化细胞并重铺细胞于选择性培养基中,或者直接加选择性培养基/每 2~4 天更换培养基,持续培养 2~3 周,目的是清除死细胞残骸,促进抗性细胞生长。
克隆独立菌路、繁殖,以用于检测(方法见 Jakoby and Pastan 1979 或 Spector et al. 1998b [《细胞试验手册》的第 86 章])。
用预冷的甲醇固定细胞 15 min,然后室温下用 10% Giemsa 染色 15 min,流水冲洗,这样可以记录细胞克隆数目。
二、物理方法
1、电穿孔转染 DNA
(1)细胞生长到对数中期或晚期时收集细胞,用包有橡皮的玻璃棒或胰酶释放贴壁细胞。4℃、500g 离心5 min(Sorvall H1000B 转子用 1 500r/min). (2)用 0.5 体积的初始培养基重悬细胞,用血细胞计数器计细胞数目。
(3)离心(同步骤 1)收集细胞,室温下用培养基或磷酸盐缓冲液重悬细胞至 2.5×106~2.5×107 细胞/ml。
(4)将 400μl 的各等份细胞悬液(106~107 细胞)加入标记好的电转化池中,冰浴。
(5)设置电转化参数。一般电容量为 1050μF。电压在 200 V 和 250 V 之间,不同细胞系所需电压不同,平均为 260 V。内部阻抗设为无穷大。进行电穿孔前先用一个装有 PBS 的电转化池放电至少两次。
(6)每一装有细胞的电转化池内加入 10~30μg、体积最大可至 40μl 的质粒 DNA。用吸管将 DNA 与细胞轻轻混匀。立刻继续进行第 7 步。
(7)立即将电转化池移至电极间放电,1~2min 后,取出电转化池,水浴,立即进行下一步操作。
(8)用带有高压灭菌吸头的微量移液器将电穿孔的细胞转移至 35 mm 培养皿中。用等体积的培养基洗涤电转化池,洗液加入培养皿。培养皿置于含 5%~7% CO2 的 37℃孵箱。
(9)重复第 6~8 步,电转化所有 DNA 与细胞样品。记录下每一电转化池的实际脉冲时间以便于比较。
(10)如要获得稳定转化体,直接进行第 11 步。如果是瞬时表达,则于电穿孔 24~96 h 后用下述方法之一检测细胞:
如果使用的是表达 E.coli β-半乳糖苷酶的质粒 DNA,检测细胞裂解液中酶活性。
如果使用绿色荧光蛋白表达载体,在 450~490 nm 光照下用显微镜检测细胞。
如果使用其它基因产物,则通过体内代谢标志物进行放射免疫、免疫印渍、免疫沉淀或测定细胞提取物的酶活性来分析新合成蛋白。
(11)分离稳定转染体:用完全培养基培养 48~72 h 后,胰酶消化细胞,用适当的选择性培养基重铺细胞。
每 2~4 天换液一次,持续 2~3 周,目的是去除死细胞残骸,并允许抗性细胞克隆生长。
本产品只适用于科研,不能用于临床诊断。严禁用于临床医疗及其他非科研用途!
 在线客服1号
在线客服1号